🌸 Das vaginale Mikrobiom – unterschätzter Schlüssel bei Kinderwunsch?
„Nicht nur der Embryo „entscheidet“ – auch die Mikrowelt der Vagina spielt eine Hauptrolle bei der Fruchtbarkeit.“
🌀 Was ist das vaginale Mikrobiom – und warum betrifft es Frauen mit Kinderwunsch?
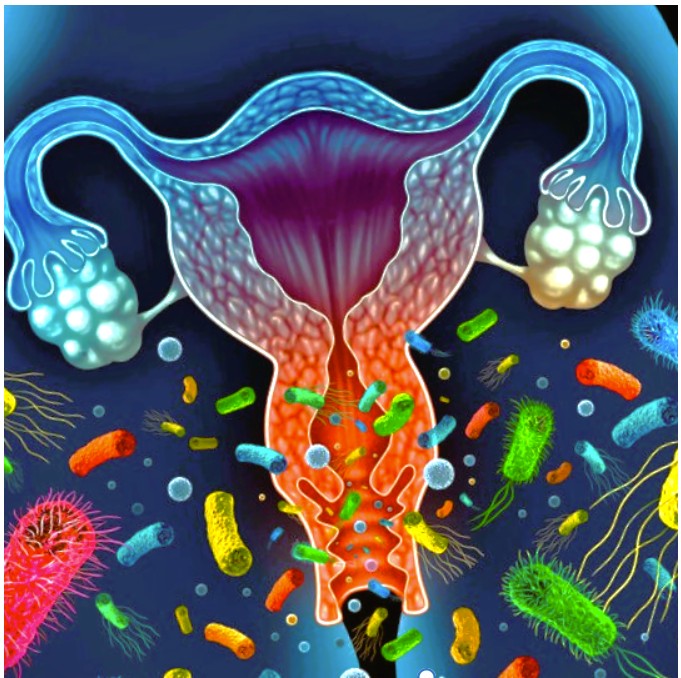
Das vaginale Mikrobiom ist die Gesamtheit der Mikroorganismen, die in der Scheide leben – mit einem klaren Hauptakteur: Lactobazillen. Diese Milchsäurebakterien halten die Vaginalflora sauer (pH 3,8–4,5), schützen vor Infektionen und stabilisieren das lokale Immunsystem. Fehlen sie oder sind andere Bakterien in der Überzahl (z. B. Gardnerella oder Candida), kann sich das direkt negativ auf die Fruchtbarkeit auswirken.
„Eine intakte Scheidenflora ist wie ein Schutzschild – sie entscheidet mit über die Chancen, schwanger zu werden.“
⚠️ Was bringt das Mikrobiom aus dem Gleichgewicht?
Zahlreiche Einflüsse können die gesunde bakterielle Balance stören:
- Hormonveränderungen: Zyklus, Schwangerschaft, Stillzeit, Pille oder Wechseljahre.
- Antibiotika: vernichten oft auch nützliche Bakterien.
- Übertriebene Intimhygiene: Vaginalduschen, Seifen und Gels können die Flora empfindlich stören.
- Ungeschützter Sex: Das alkalische Milieu von Sperma verändert kurzfristig den pH-Wert.
- Stress und Ernährung: auch Darm und Psyche beeinflussen die Scheidenflora über Hormone und Immunfaktoren.
🤰 Fruchtbarkeit und Scheidenflora – was sagen die Studien?
„Eine gute Vaginalflora ist wie guter Boden für den Samen – sie „entscheidet mit“, ob der Embryo angenommen wird.“
Wissenschaftliche Untersuchungen zeigen:
- Frauen mit dominanter Lactobazillenflora haben eine signifikant höhere Schwangerschaftsrate bei IVF (> 60 %).
- Bei gestörter Flora sinkt die Erfolgsrate auf unter 25 %.
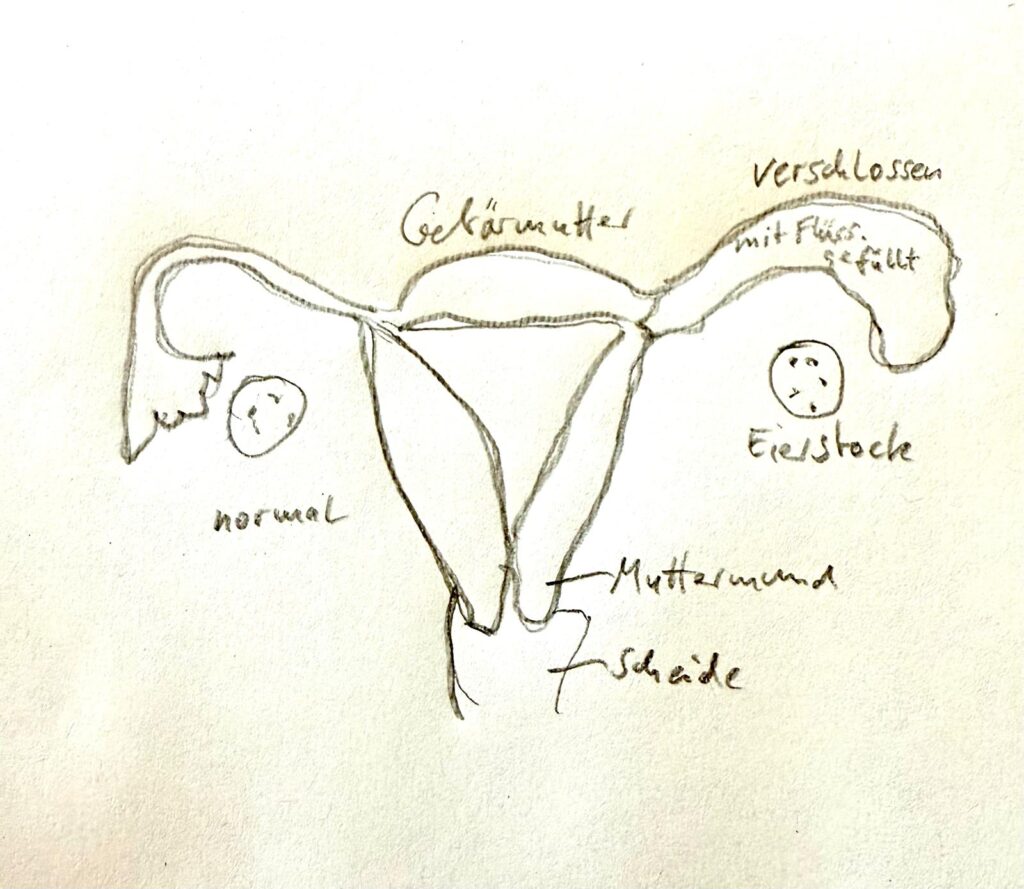
- Die Gebärmutterflora (Endometrium) spielt ebenfalls eine Rolle – eine Dysbiose dort kann die Einnistung erschweren.
Eine gestörte Scheidenflora bleibt oft symptomlos, kann aber zu:
- ausbleibender Einnistung
- wiederholtem Abgang
- entzündlicher Umgebung im Uterus führen
🔬 Wie lässt sich das Mikrobiom untersuchen?
Die moderne Mikrobiomdiagnostik – z. B. durch PCR- oder NGS-Analysen – kann bereits aus einem einfachen Vaginalabstrich ein detailliertes Bakterienprofil erstellen.
„Viele Dysbiosen bleiben unentdeckt – eine Mikrobiomanalyse ist wie ein Blick unter die Oberfläche.“
🧪 Therapiemöglichkeiten bei Dysbiose
- Antibiotika: bei bakterieller Vaginose gezielt gegen Gardnerella & Co.
- Probiotika: spezifische Lactobazillenstämme (z. B. L. crispatus, L. gasseri) oral oder vaginal.
- Prä- & Synbiotika: fördern die Vermehrung der guten Bakterien.
- Vaginale Mikrobiom-Transplantation (VMT): neuartige Methode bei therapieresistenten Fällen – mit bis zu 80 % Erfolg (Experimentalphase).
🌱 Was kann ich selbst tun?
- Probiotika einnehmen: in Absprache mit Arzt oder Heilpraktiker – besonders nach Antibiotika oder bei IVF.
- Sanfte Intimhygiene: keine Seifen oder Vaginalduschen, am besten klares Wasser.
- Zuckerarme, ballaststoffreiche Ernährung: unterstützt auch den Darm, der hormonell mit dem Zyklus verknüpft ist.
- Stress reduzieren: chronischer Stress beeinflusst den pH-Wert über Cortisol.
- Regelmäßige Mikrobiomchecks: besonders bei Kinderwunsch, Endometriose, oder wiederholtem Einnistungsversagen.
📌 Fazit für Frauen mit Kinderwunsch
Das vaginale Mikrobiom ist nicht nur ein Hygienethema – es ist ein echter Fruchtbarkeitsfaktor. Wer seinen Kinderwunsch ganzheitlich angehen möchte, sollte auch die „guten Bakterien“ in die Strategie einbeziehen.
„Die Natur hat sich etwas dabei gedacht: Ohne Milchsäurebakterien kein Gleichgewicht – und oft auch keine Schwangerschaft.“
Dr. Peet, 4.8.2025